作者:张珊文/肖绍文/吕有勇 来源:《中华物理医学与康复杂志》2002年8月第24卷第8期
【摘要】目的 评价腺病毒介导p53基因对人胃癌细胞热增敏的作用。方法 以重组腺病毒介导p53基因悬液(Adp53)感染4种不同p53状况的人胃癌细胞,用免疫组化法和Western blot法检测p53蛋白在胃癌细胞中的表达;用细胞存活分数来反映细胞增殖状况;用TUNEL法来检测细胞调亡。感染Adp53的W和M胃癌细胞经42℃ 2h或43℃ 0.5h加温后24h,用流式细胞计检测细胞周期分布和凋亡;胃癌细胞的种植肿瘤内注射Adp53悬液后48h,行43℃0.5h加温,以肿瘤相对体积增长曲线观察肿瘤抑制情况。结果 高效靶上比(100MoI)Adp53产生细胞高转染率和p53基因在4种胃癌细胞中均高表达,并产生G2/M期阻滞和凋亡及细胞增殖抑制。Adp53基因的作用不依赖胃癌细胞内在的p53状态。如果以凋亡作为热效应,Adp53对2种加温方式的热增敏比,对W细胞为1.6~3.3,而对M细胞为1.8~2.1。Adp53对W细胞肿瘤43℃ 0. 5h加温的热增敏比为1.7,而对M细胞肿瘤为1.6。结论 腺病毒介导p53基因提高了人胃癌细胞的热敏感性,这种作用不依赖于细胞内在p53状况。本实验为p53基因治疗与热疗结合提供了可靠的实验依据。
【关键词】胃癌 热疗 腺病毒介导p53基因
Enhanced effect of adenovirus-mediated p53 gene on thermo sensitivity of human gastric carcinoma cells lines
ZANG shan wen, XIAO shaocen, LU Youyong. Department of Radiotherapy, the school of oncology. Bejing university, beijing 100036, china.
【Abstract】 objective To evaluate the enhanced effect of adenovirus-mediated p53 gene on thermo sensitivity of human gastric care in oma cell lines. Methods Recombinant adenovirus expressing wild-type p53 gene(adp 53)was trans fec ted into four human gastric carcinoma cell lines with different p53 gene tie status. P53 protein expressionwas detected by immuno-histochemistry as say and the western blot assay. Cell survival and apoptosis of the cells wasassessed using a clo no geni c and TUNEL assay, respectively. W and M cells which had been infected with Adp53 were heated at 42℃ for 2h or 43℃ for 0. 5h. Then 24h later cell cycle distribution and a pop to tic rate were deter-mined by flow ey tome try. Nude mice xe no graft models of W and M cell were intra tumor ally injected with Adp53, 48h later. And after the heating at 43℃ for 0. 5h, relative volume growth curve of the tumor was depicted to evaluate the tumor regression. Results inducing of G2/M arrest and apoptosis and inhibition of tumor cell proliferation were ob-served after the infection of Adp53 at high M01(100 M01) which gave rise to high Adp53 transfer rate, and eff-cie ntl y p53 protein expression was demonstrated in four human gastric carcinoma cell lines in this study. The thermo-enhaneement ratio of Adp53 at two heating schedules described above was 1. 6~3. 3 for W cell and 1. 8~2. 1 for M cell in vitro. Thermoenhancement ratio of Adp53 at 43℃ for 0. 5h was 1. 7 for W cell planting tumor and 1. 6 form cell planting tumor in vivo. Conclusion This study demonstrated that Adp53 transfer increases the cellular thermo-sensitivity of human gastric carcinoma in vitro and in vivo independent of its in tri sic p53 status, and supp or led that combination of p53 gene therapy with hyperthermia may enhance the adenovirus-mediated p53 gene on thermos ens it iv-ity of gast rie cells.
【key words 】 Gastric carcinoma; Hyperthermia; Adenovirus -mediated p53 gene
热产生的DNA损伤导致肿瘤细胞周期阻滞,并引导细胞程序性死亡,即凋亡(apoptosis)。正常功能的野生型p53对热引起的细胞周期阻滞和凋亡起促进作用,而p53基因的变异将失去这种功能,这是产生肿瘤细胞热抵抗性的重要原因之一[1-2]。通过腺病毒介导p53基因(adenovirus- mediated p53 gene, adp53)转染的方法,可以有效地重建肿瘤细胞内变异的p53基因,使肿瘤细胞的热敏感性明显提高[3]。复制缺陷型重组腺病毒载体是目前应用最多的基因载体。它具有以下优点:易纯化,可获很高滴度,可用于临床肿瘤治疗[4.5];宿主范围广,感染率高;基因组为36kb,可插入较大的外源基因;遗传毒性低,由腺病毒转载的外源基因是以附加型方式表达而不整合入宿主基因组,既有效又安全[6,7]。Adp53悬液感染肿瘤细胞,外源p53基因在细胞核内高度表达,并产生细胞周期G2/M期阻滞和凋亡及细胞增殖生长抑制作用[7-9]。Adp53应用于肿瘤临床已成为肿瘤基因治疗的新策略[4,5]。Adp53可提高放疗和化疗的疗效,是否也可以提高热疗的疗效,所见报道极少[3]。本研究的目的是采用更接近临床应用的Adp53感染胃癌细胞,观察外源p53基因在胃癌细胞内的表达、抑制肿瘤细胞增殖以及提高肿瘤细胞热敏感性的作用和机制,为p53基因与热疗结合的临床治疗提供实验依据。
材料与方法
一、细胞系与培养条件
胃癌细胞:基因转录方法构建的3种胃癌细胞,即含野生型p53基因的BCC823细胞(略写为W)、含突变型p53基因的BGC823细胞(略写为M)、含空载质粒即p53基因缺失的BGC823细胞(略写为Neo);有p53变异的亲本人胃癌细胞BCGC823细胞(略写为823)。这4种不同P53状况的人胃癌细胞系应用于本实验中。
293细胞:人胚肾细胞系,带有腺病毒的E1基因,作为腺病毒扩增的种子细胞。
胃癌细胞和293细胞都由本院肿瘤分子生物学实验室提供。以上细胞都以含有10%胎牛血清和抗生素的DMEM培养基传代培养。
二、重组腺病毒的扩增、纯化和滴度测定
重组腺病毒p53基因由中山医科大学肿瘤医院曾益新教授惠赠。Adp53为野生型p53基因表达载体和析)E1基因缺失的5型腺病毒的重组体,其中p53基因表达载体由巨细胞病毒(CMV)启动子、野生型p53基因(CDNA)和SV40多聚腺苷信号组成,并携带绿色荧光蛋白基因(GFP)。在荧光显微镜下为可见绿光的Adp53-GFP阳性细胞[6,7]。将293细胞接种在250cm2的大培养瓶中,待细胞生长至90%汇合状态时,以20效靶比( multiplicity of infection,MOI)的病毒量感染细胞24~48h后,待细胞出现病变效应(Cyto-pathic effect,CPE)而未破时,收获细胞,离心,PBS重悬细胞,于-196℃和37℃间反复冻融3次后,离心,去除细胞碎片,取上清15000r/min离心15min,再经Cscl密度梯度离心法进一步纯化病毒[2,8-10]。通过空斑实验测定病毒的滴度(单位为 plaque-forming units,pfu/ml,即空斑形成单位/毫升) [8,9]。
三、重组腺病毒转染效率的测定
分别用0、50、100、150和200MOI的Adp53(GFP荧光基因)感染4种胃癌单层细胞,每种滴度各2个平皿。2h后吸去病毒液,各加3ml培养液继续培养,24-48 h后在荧光显微镜下计数GFP表达阳性的细胞数,同时在可见光下记数该视野内的总细胞数,计算转染率(即GFP表达阳性的细胞数与总细胞数的比率)[9]。以选择最佳滴度和感染时间。
四、免疫组化法检测p53蛋白表达[8,9]
胃癌细胞以5x10³/瓶接种于75cm²的培养瓶中,12h后用MOI为100的Adp53感染单层细胞,Oh、12 h、24h、48h、3 d、4d、5d、6d分别消化细胞,离心涂片,以100%冷乙醇固定,通过免疫组化法检测Adp53介导的p53基因在细胞中的表达。所用抗体为鼠抗人p53蛋白单克隆抗体D。-1(D0公司)。
五、Western blot法检测p53蛋白表达[8]
提取Adp53(100 MOI)感染2d后的4种胃癌细胞的总蛋白及相对应的未转染Adp53的4种胃癌细胞的总蛋白,用BCA法行蛋白含量测定。取75~100 ug蛋白在10%(体积分数)SDS-PACE胶上电泳,然后转膜,杂交,采用DAB法染色,进行Western blot法检测。抗体为鼠抗人p53蛋白单克隆抗体D0-1。
六、细胞存活率测定
4种胃癌细胞以103个分别接种于直径60cm的培养皿中,6 h后分别加入100 MOI的Adp53,而对照组取10²细胞/皿,不加Adp53。细胞培养14d, Giemsa染色,以克隆形成数计算存活率,以对照组的克隆形成率为着盘率。根据公式:细胞存活率=加Adp53后的克隆数/接种细胞数x着盘率,计算加入Adp53(100 MOI)后4种细胞的存活率。
七、末端标记法原位检测凋亡效应(TUNEL分析)[9]
收集Adp53感染后2d和未经处理的4种胃癌细胞,消化、离心、涂片,4%多聚甲醛固定,通过3'末端标记法原位检测细胞凋亡(德国Boehringer -mannheim公司)。
八、流式细胞仪分析细胞周期分布和凋亡比例[9]
4种细胞经Adp53感染后48h,或单纯加温后24h,或Adp53感染后48h加温后24h收获细胞,行流式细胞计分析(FACS240型),测定细胞DNA含量,勾绘出细胞周期分布直方图,在CO/G1峰前出现独特的亚二倍体细胞的Sub-G1峰被确定为特异的伴DNA降解的凋亡细胞峰。
九、加温实验[1]
W细胞和M细胞,单层培养于培养瓶,单纯加温组或Adp53感染48h后加温组,拧紧瓶盖,将培养瓶塑封后浸泡于恒温水浴锅中(JULABO LGMBH型),控带温误差为±0.03℃,42℃2h或43℃ 0.5h加温后换以新鲜培养基,继续传代培养。每次实验每种细胞2瓶,重复实验3次。
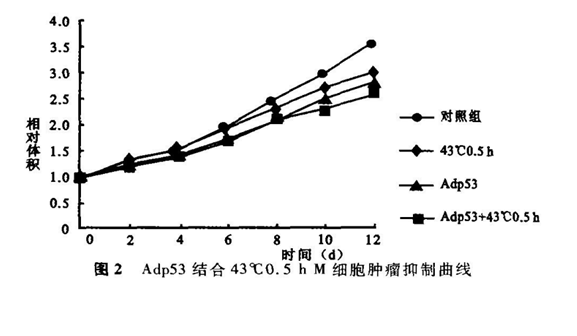
W细胞和M细胞悬液种植于裸鼠右下肢腹股沟皮下,肿瘤直径达5~10mm时,麻醉后将裸鼠右下肢固定,将荷瘤下肢浸泡于43℃ 0.5h。用游标卡尺量取瘤体的两个直径,以公式π/6(直径1+直径2)/2来计算肿瘤体积。以观察天数为横坐标,以加热当日的体积为1,以肿瘤体积增加的倍数(即相对体积)为纵坐标,将对应于观察天数的相对体积点连接为肿瘤热抑制曲线。每次实验每种细胞种植裸鼠4只.重复实验2次。3种试验下的抑瘤率=(加温后12d对照组相对体积-试验组相对体积)÷(对照组相对体积)。Adp53的热增效比=Adp53结合加温的抑瘤率/单纯加温的抑瘤率。
结果
一、高滴度重组缺陷型腺病毒的制备
经293细胞繁殖的重组病毒p53原液,经Cscl密度梯度超速离心后,再经空斑实验测定其滴度为3.0×1012pfu/ml,供实验使用。
二、腺病毒对胃癌细胞转染率与病毒剂量MOI密切相关
胃癌细胞对腺病毒比较敏感,并随病毒量的加大,转染率逐渐升高。当病毒量为50 MOI时,4种胃癌细胞GFP阳性率均在40%左右;当病毒量为100 MOI时,感染率达(80~90)%。故本实验病毒量以100 MOI为佳。
三、免疫组化法显示外源性p53基因在胃癌细胞中的表达
100MOI剂量Adp53感染4种胃癌细胞后12 h,p53蛋白在核内有表达,36 h呈强阳性表达,48 h表达最强,到第5天则已为弱阳性表达,第6天接近不加Adp53的对照组。本实验选病毒感染48h后结合加温。而不加Adp53的Neo和823对照组细胞未见p53表达,而W和M对照组细胞则呈弱阳性表达。
Western Blot结果显示,4种胃癌细胞加100 MOI的Adp53后,在53 KD位置上均有一条清晰的杂交带,不加Adp53的对照组823和Neo细胞在同一位置无杂交带,而对照组W细胞和M细胞则在53 KD处有很浅的一条杂交带。
四、Adp53对4种胃癌细胞生长的影响
加入Adp53(100 M0I)后,4种胃癌细胞的克隆形成率分别为:W细胞45%、M细胞37%、Neo细胞41%、823细胞43%,而对照组4种胃癌细胞的克隆率分别为:W细胞72%、M细胞84%、Neo细胞79%、823细胞80%。故Adp53对4种胃癌细胞生长抑制率分别为:W细胞37%、M细胞56%、Neo细胞48%、823细胞46%,以对M细胞生长抑制作用最明显。
流式细胞分析结果显示,加入Adp53(100 MOI)后,对该4种细胞,G2期细胞增多,S期细胞减少,与对照组比较,差异有非常显著性(P<0. 01),而G1期细胞变化不大。
五、Adp53基因可诱导4种胃癌细胞凋亡
以100MOI的Adp53感染4种胃癌细胞48h后,流式细胞分析结果显示,与对照组比较,W细胞凋亡率平均增加近1倍,M细胞凋亡率平均增加2.6倍,而Neo、823细胞凋亡率平均增加倍数分别为1.6倍、2.1倍。TUNEL结果显示,加入Adp53后,可诱导4种胃癌细胞凋亡,但凋亡比例不一样,其中W细胞约20%, M细胞、Neo细胞、823细胞约25%~30%,以M细胞为最高。
六、Adp53结合加温后24h细胞周期分布
对W细胞来说(表1),与空白对照组比较,单纯Adp53作用出现G2/M期明显阻滞,凋亡率增加2.3倍;单纯42℃ 2h或43℃ 0.5h加温组的各细胞周期没有发生明显变化,凋亡率分别增加1.5倍或4.5倍;Adp53结合42℃ 2h或43℃0.5h加温,发生G2/M期更明显阻滞,凋亡率分别增加7.2倍或7.7倍。如果以凋亡作为热效应,Adp53对42℃2h的热增效比为3.3,而对43℃ 0.5h的增效比为1.6。对M细胞来说(表2)结果也和W细胞结果一样,Adp53对42℃ 2h的增效比为2.1,而对43℃ 0.5h的增效比为1.8。W细胞种植肿瘤相对生长曲线(图1)显示:单纯43℃ 0.5h加温和单纯Adp53都使肿瘤生长受到抑制,肿瘤抑制率分别为15.8%和21.8%。而Adp53结合43℃ 0.5h肿瘤生产抑制更明显,肿瘤抑制率为27.2%,Adp53的热增效比为1.7。M细胞种植肿瘤相对生长曲线(图2)显示结果与W细胞相似,单纯加温、单纯Adp53和Adp53结合加温,肿瘤抑制率分别为24.2%、31.0%和37.8%,Adp53的热增效比为1.6。



讨论
Reiser [7] 报道肝癌细胞感染Adp53后,p53蛋白在细胞核内表达,并伴以p21基因和Bax基因表达,和伴以Cd95(Apo-1/fas)基因表达上调,这也许就是Adp53转染使细胞周期G2/M期阻滞和诱导凋亡和细胞增殖生长抑制的机制。细胞病毒感染率随病毒剂量即MOI的增加而增加,本实验采用100 MOI达到细胞90%左右的高感染率,伴以p53蛋白在细胞核内高效表达,同时出现细胞周期G2/M期阻滞和诱导凋亡和细胞增殖生长抑制,这与国内外报道一致[6-9]。可引起DNA损伤的放射线、化学剂和热,都产生细胞周期阻滞和诱导凋亡,正常功能的野生型p53基因即促进这些效应,p53基因缺失或变异即减弱甚至破坏了这些效应。人类肿瘤的50%以上都存在p53变异而功能失常,从而降低了治疗的疗效。通过导入野生型p53来重建细胞内变异的p53已成为肿瘤治疗的新策略[4-5]。本研究结果证实:无论用细胞培养共染还是细胞种植肿瘤采用瘤内注射方法,都显示了Adp53对胃癌细胞的热增敏作用,为热疗临床结合p53基因治疗提供了可靠的实验依据。
参考文献
[1].张珊文,肖卫群、吕有勇.抑癌基因p53提高人胃癌细胞热敏感性的作用.中华物理医学与康复杂志,2000,2:94-96.
[2].Matsumoko H. Takahashi A. Wang X. Et al. Transfection of p53-knockout mouse fi br oblasts with wild- type p53 increases the thermos en-sitivity and stimulates upoptosis induced by heat stress. Int j radi at on-col phys, 1997. 1:197-203.
[3].Qi V, we in rib L, ma N, et al. Adenaviral p53 gene therapy promotes heat- induced apoptosis in a na so pharyngeal carcinoma cell line. Int J Hyperthermi证、20)1,】:38-47.
[4].clay man GL, el. Naggar Ak、lippman SM, et al. Adenovirus- mediated p53 gene transfer in patients with advanced recurrent head and neck squamous cell carcinoma. J clin oncol, 1998, 6:2221-2232.
[5].swisher SG. Roth JA, nem una it us J. Et al. Adenovirus- mediated p53 ed non- small。 cell lung cancer. J Natl cuncer Inst, 1999,91:763-771.
[6].He P, tang Z, ye S. The expression and localization of wild- type p53.CFP fusd gene on human high- metasausis b he pato celo lar car cino mscell line. Zhonghan Gan zang Bing za zhi, 2000. 2:105-107.
[7].Reiser M, neumann I, sch mie gel W, et al. Iaduction of cell pro lifer a-tior a rest and apoposis in hepabomua cels h rough adenowial. Medited transfer of p53 gene. J Hepatol. 2000, 5:771. 782.
[8].Brand K, klorke R, po beta ling A, et al. Induction of apoptosis and C2/M arrest by infection with replication- deficient adenovirus at high multiplicity of infection. Cene Ther. 1999, 6:1054-1063.
[9].邱兆华,劳妙芬,王艳飞,等.腺病毒介导多基因在肺癌细胞中的表达及致两亡效应。中国肿编生物治疗杂志.099.2:83.86.
[10].Kanegae Y, maki murs M, saito 1. A simple and ef ici ent method for pur if ica ui on of infectious recombinant adenovirus. Jpn J Med sei Biol,1994, 47:157. 166.(收稿日期:2002-03-29)










